Therapie
Der Morbus Perthes ist eine selbstheilende Erkrankung. Grund für eine Behandlung ist das Risiko einer Verformung des Hüftkopfes und die frühe Entwicklung einer Hüftarthrose.
Die Internationale Perthes Studien-Gruppe (IPSG) schlägt eine Behandlung nach Alter vor (https://perthesdisease.org/treatment-by-age/):
AGE LESS THAN 6 AT ONSET:
treat symptoms (pain, limping, and decrease in hip joint movement) by nonsurgical means like rest, limiting running and jumping activities, anti-inflammatory medicine and crutches/ walker/wheelchair as needed).
AGE 6-8 AT ONSET:
non-operative treatments (similar to less than 6 year old patient and brace) or operative treatments (femoral or pelvic bone surgery) can be used but we do not know which is better at this time. This is why IPSG is studying the outcomes of patients treated non-operatively and operatively in this age group.
AGE 8-11 AT ONSET:
AGE OVER 11 AT ONSET:
conventional femoral or pelvic bone surgeries are not as effective in this age group compare to the younger patients. Newer treatments such as multiple drilling of femoral head to create channels for blood vessels to grow back and hip distraction using an external fixator to protect the femoral head are being done in some centers. IPSG will be comparing the results of these newer procedures.
Daraus lässt sich ableiten, dass bei Kindern unter 6 Jahren eine ärztliche Beobachtung mit regelmäßiger Bildgebung (Sonographie, Röntgen, MRT) und Überwachung durch Krankengymnastik ausreichend sein kann (supervised neglect – Lloyd-Roberts, 1982).
Bei Verschlechterung ist eine strikte konservative Therapie angezeigt, im Prinzip eine Hüftgelenksschonung durch Entlastung des Beins (unloading – Kim, 2012).
Unsere Empfehlungen für den Alltag:
- In der Wohnung nur Krabbeln oder Benutzung eines Rollbretts (z. B. „Möbelhund“) oder „Krabblers“ (http://shop.stator-ffm.de).
- Außerhalb der Wohnung Buggy oder Rollstuhl. Für kurze Wegstrecken Benutzung von Unterarmgehstützen unter Entlastung, bestenfalls Kontaktbelastung (2 – 3 kg).
- Im Rollstuhl Verwendung eines Spreizkeils von ≥ 40° zwischen den Oberschenkeln, der mit einem Klettband auf dem Sitz fixiert werden kann. Alternativ kleiner Spielball, mit einem Netz gehalten.
- In der Nacht Anlegen eines großen Schaumstoff-Spreizkissens von 70°.
- Professionelle Physiotherapie, anfänglich 2 x pro Woche. Gangschulung unter Entlastung mit Unterarmgehstützen. Bewegungsübungen unter Traktion zum Erhalt bzw. zur Verbesserung der Hüftabduktion. Diese sollte mindestens 30° betragen, damit die seitlichen Anteile des Hüftkopfes unter der Pfanne bleiben und nicht etwa eingedellt werden (cf. Abb. 4). Es darf sich keine Adduktionskontraktur auf dem Boden eines erhöhten Tonus/ Spasmus der Adduktoren entwickeln. Insofern sind regelmäßige KG-Befundberichte wichtig!
Zum Verständnis: Wodurch kommt es beim M. Perthes zu einer Einschränkung der Beweglichkeit? Bei ungünstigem Verlauf (Stulberg Klasse IV und V) sicherlich durch die „Umformung der Gelenkanteile“ (Coxitis deformans juvenilis, Perthes, 1910, ). Und in der frühen Phase? Narkoseuntersuchungen im Fragmentationsstadium sprechen dafür, daß Schmerz und Muskelspasmus die Ursache sein dürften (Stanitski, 2007). Dies ist von Bedeutung für die Physiotherapie. Hüftrotation und Hüftbeugung/-streckung bedürfen wahrscheinlich keiner besonderen Aufmerksamkeit. Die Rotation bessert sich, wenn der Reizzustand des Gelenks unter Schonung (und evtl. Containment-OP) nachläßt. Beugung/Streckung hingegen bleiben lange gut erhalten, weil die Scharnierbeweglichkeit (roller-bearing-type joint motion, Catterall) im Alltag ständig genutzt wird. - Schwimmen günstig, nach Möglichkeit zweimal pro Woche. Kein Springen vom Sprungbrett!
- Sinnvoll ist die Kontrolle der Schonung des Hüftgelenkes (bzw. der gebremsten Aktivität des Kindes)mit einem Pedometer oder Aktivitäts-Tracker. Nach Möglichkeit sollte die tägliche Schritt-/Punktzahl bei 3.000 – 5.000 liegen, statt bei 20.000. Die Werte sollten zur Dokumentation notiert werden (Schrittzahlkalender über Informationsmaterial). Die konservative Therapie der Erkrankung durch Hüftgelenksschonung in Form einer konsequenten Entlastung ist in der Vergangenheit kontrovers diskutiert worden. Inzwischen ist die Wirksamkeit der Entlastung tierexperimentell belegt (Kim, 2012).
- Bei Verschlechterung der Abduktion:
- Häusliche oder stationäre Extensionsbehandlung mit Gewichten bis ca. 4,5 kg. Zur Vermeidung von Druckstellen an Fußrücken und Ferse hat sich der „Heelift Traction Boot“ bewährt.
- Spreizgips („Petrie Cast“). Evtl. passive und aktiv-geführte Bewegungssübungen nach Gipsentdeckelung.
- Medikamentös
-
- Wegen eines endemischen Vitamin D-Mangels in Deutschland Gabe von 1 x 1000 IE Vitamin D3 täglich, z.B. 1 Vigantolette 1000. Besser: Bestimmung des Vit. D-Spiegels im Blut über einen Kinderarzt und angepaßte Dosierung, damit der Spiegel rasch auf 40 – 50 ng/ml steigt. Evtl. 3- bis 4-monatliche Spiegelkontrollen. Außerdem: Kalziumreiche Kost (ausreichend Milchprodukte, speziell Hartkäse; Gerolsteiner Mineralwasser – cf. flyer_knochengesunde_ernährung, IOBM, UKE).
Eine konservative Therapiemöglichkeit ist die Extensionsbehandlung. Über eine am Bett montierte Rolle wird mehrere Stunden täglich mit Gewichten am Bein gezogen. Hierdurch wird der kranke Hüftkopf entlastet. Diese Behandlung kommt insbesondere bei schlechter Beweglichkeit vor einer Operation infrage. Catterall: Restore movement before you cut the bone.
Wie aus obigem Schema ersichtlich stehen bei älteren Kindern operative Maßnahmen im Vordergrund.
Dabei handelt es sich um folgende Verfahren:
A. Sog. Containment-Operationen
- Hüftnahe Umstellungsosteotomie des Oberschenkels in Varus (proximal varus osteotomy – PFO)
- Beckenosteotomie oberhalb der Hüftpfanne nach Salter (innominate osteotomy)
- Pfannenschwenk-Osteotomie nach Tönnis (Triple oder Becken-Dreifachosteotomie) bzw. Periazetabuläre Osteotomie nach Ganz (Berner Periazetabuläre Osteotomie – PAO)
- Kombinationsverfahren von 1 + 2 oder 1 + 3
B. Mehrfache Epiphysen-Anbohrung (multiple epiphyseal drilling, Aruwajoye, 2018)
C. Passagere Hüftdistraktion mit einem gelenkübergreifenden Fixateur (Arthrodiastase) und nachfolgender Containment-OP, meist PFO
Anmerkung zum Verständnis
Wie ist man auf „Containment-Operationen“ (containment surgery) beim M. Perthes gekommen? Wer hat die erste proximale Femur-Varus-Osteotomie (PFO) durchgeführt?
DER NEUE FALL
- Beginn der Erkrankung, onset (Zeitpunkt der erste Beschwerden: Hinken, Schmerzen) –> aktuelle Dauer
- Alter bei Beginn
- Risikofaktoren für schweren Verlauf: Alter 8-11 und darüber, hoher Bewegungsdrang, geringe Compliance für Entlastung
- Untersuchungsbefund, Physiotherapie-Befund
- Bildgebung: Röntgen-BÜ + Lauenstein (mögl. bds.), MRT, Sonographie
- Ausmaß des Befalls (der Nekrose, der Perfusionsstörung in der MRT), involvement
- Stadium: Waldenström/ modif. Elizabethtown-Klassifikation
- Containment: gut, gefährdet, (drohender) Verlust
- Labor (Vit. D-Spiegel, evtl. osteologisches Basislabor und D-Dimere), selten molekulargenetische Untersuchung
Therapievorschlag:
- Beobachtung
- Konservative Behandlung oder
- (frühe) operative Behandlung
- Begleitend: Vitamin D-Prophylaxe und calciumreiche Ernährung
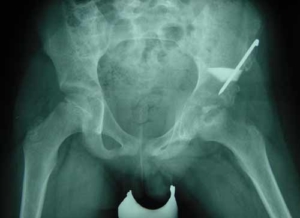
Röntgenaufnahme des Beckens im Anschluss an eine Beckenosteotomie in der Technik nach Salter. Die helle eckige Struktur oberhalb des linken erkrankten Hüftkopfes ist ein Hydroxylapatit-Keil, der das durchtrennte Becken in Position hält. Ein Bohrdraht sichert die Montage. Es resultiert keine Übungsstabilität, deshalb zusätzlich äußere Ruhigstellung mittels Becken-Bein-Fuß-Gips. Letzteres ist nach Beckenosteotomien in neuerer OP-Technik nicht mehr erforderlich.
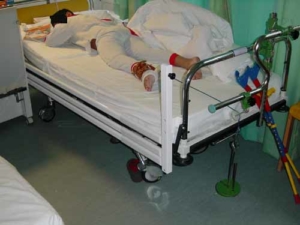
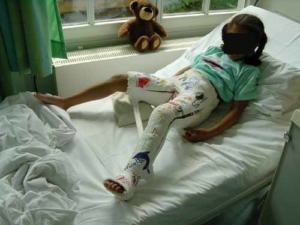
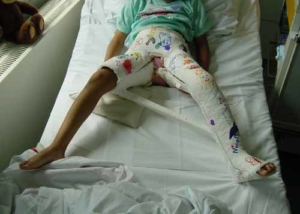
Die Nachbehandlung erfolgt in einem Gips für 6 – 7 Wochen, der das Becken und das Bein der betroffenen Seite vollständig sowie das Bein der anderen Seite bis zum Knie umschließt. Er wird in Spreiz- und leichter Beugestellung angelegt, damit der Hüftkopf gut und ohne Druck in der Pfanne zentriert ist. Der Gips wird in aller Regel gut akzeptiert. Das Pflegepersonal instruiert die Familie in der Pflege, so daß die Kinder die meiste Zeit im Gips zuhause verbringen können. Nach 6 Wochen erfolgt die Wiederaufnahme zur Gipsentfernung, Röntgenkontrolle und gelenkmobilisierenden Krankengymnastik. Die Operation verbessert die Aussicht auf ein normales Hüftgelenk, aber der eigentliche Heilungsverlauf wird nicht abgekürzt. Deshalb Entlastung im Rollstuhl bis in das Regenerationsstadium (bis zum Aufbau des „lateral pillar“, s. o.).
Nach der Operation wird ein Becken-Bein-Fuß-Gips für 6 – 7 Wochen angelegt, damit der Knochen heilt und die Hüfte maximal entlastet wird. Die Kinder gewöhnen sich schnell an den Gips und können nach einer Woche Krankenhaus zuhause weiter gepflegt werden.
Zur Entfernung des Gipses ist die stationäre Wiederaufnahme erforderlich. Der Gips wird aufgesägt und nach Röntgenkontrolle wird mit der Mobilisation im Rollstuhl begonnen.
Entlastungsschiene?
PROBLEM IM KRANKHEITSVERLAUF: Trochanterhochstand – Vorbeugen, behandeln oder ignorieren?
NEUE ASPEKTE IN DER BEHANDLUNG?
Im Prinzip kommt eine medikamentöse Behandlung des M. Perthes mit einem Wirkstoff, der den Knochenabbau hemmt und gleichzeitig den Knochenaufbau fördert, in Betracht. Romosozumab wäre in Kanditat. Dieses Mittel hat aber als Adjuvans bei der Behandlung von osteoporotischen Frakturen (sog. fragility fractures) enttäuscht. Insofern würde man es derzeit nicht für den M. Perthes in Erwägung ziehen wollen. Abaloparatide, ei